Denis deBlois PhD – Faculté de pharmacie – Université de Montréal
Près de 50% des médicaments sur le marché ciblent des récepteurs membranaires couplés aux protéines G, communément appelés GPCR.
En décembre dernier, le Prix Nobel de chimie 2012 était remis à deux chercheurs, Robert J. Lefkowitz et Brian K. Kobilka, des Université Duke et Stanford, respectivement, pour leurs travaux sur la structure et la fonction des GPCR . En 25 ans, c’est la deuxième fois qu’un Prix Nobel vient reconnaître des travaux portant spécifiquement sur les GPCR. Dans les deux cas, les travaux ont un lien particulier avec la Société québécoise d’hypertension artérielle (SQHA).
Le premier médicament spécifiquement désigné pour agir via un GPCR fut le propranolol, un bêta bloqueur et antihypertenseur développé par Sir James Black au sein de la compagnie ICI Pharmaceuticals au début des années ‘60s. Le Prix Nobel de Médecine fut remis à Sir Black en 1988 pour cette percée scientifique importante : pour la première fois de l’histoire, un médicament était développé en visant une cible pharmacologique précise plutôt que par une approche essai-erreur dans des modèles animaux ou par l’observation d’effets cliniques inattendus chez les patients.
C’est sensiblement à la même époque qu’un jeune clinicien du nom de Jacques de Champlain entamait une brillante carrière de chercheur dans le domaine de l’hypertension. Futur fondateur et président de la SQHA, Jacques de Champlain fut un pionnier dans l’étude du rôle physiopathologique du système neveux autonome , incluant les récepteurs bêta adrénergiques, dans les maladies cardiovasculaires.
De nos jours, plusieurs autres classes de médicaments cardiovasculaires visent des GPCR, notamment les récepteurs de l’angiotensine II, les récepteurs de l’endothéline et les récepteurs alpha adrénergiques. Les GPCR représentent la plus grande famille de protéines de signalisation du génome humain. Ces protéines membranaires sont impliquées dans la détection et la transmission intracellulaire des signaux extracellulaires de type neurotransmetteurs, endocriniens, olfactifs et même lumineux. Pas étonnant qu’ils soient une cible si fréquente des médicaments !
Le mode de transmission des signaux par les GPCR est un principe fondamental en biologie cellulaire et en physiopathologie. Les travaux de Lefkowitz au cours des 35 dernières années ont grandement contribué à comprendre comment les GPCR transmettent les signaux à travers la membrane cellulaire en formant un complexe multimérique avec des protéines G intracellulaires qui relaient ensuite le signal vers les protéines effectrices génératrices de seconds messagers cytoplasmiques, telles l’adénylate cyclase et l’AMP cyclique. Ce paradigme fonctionnel, initialement proposé au sein du groupe de Lefkowitz, est d‘ailleurs à l’origine de l’appellation GPCR (récepteur couplé aux protéines G).
Depuis, plusieurs groupes de chercheurs, dont celui de Lefkowitz, ont révélé que les GPCR peuvent transmettre des signaux intracellulaires indépendamment des protéines G. En fait, il apparaît maintenant que certains ligands des GPCR peuvent agir de façon « biaisée », en modulant différentiellement des voies dépendantes et indépendantes des protéines G. Ces découvertes récentes remettent donc en cause le paradigme classique qui décrit le fonctionnement des GPCR.
Certaines de ces découvertes sur la signalisation biaisée des GPCR sont le fruit des travaux de chercheurs québécois, dont ceux du Dr Michel Bouvier, ancien récipiendaire du prix du Jeune chercheur de la SQHA et actuellement établi comme professeur de biochimie à l’Université de Montréal après une formation doctorale au sein du laboratoire de Jacques de Champlain et une formation postdoctorale au sein du laboratoire de …Robert Lefkowitz, rien de moins ! Par exemple, le groupe Bouvier a pu montrer que des antagonistes beta adrénergiques couramment utilisés en clinique peuvent bloquer certains effets dépendants des protéines G du récepteur tout en activant d’autres voies de signalisation indépendantes des protéines G, notamment via la voie beta-arrestine . Ces travaux sont susceptibles de mener au développement de nouveaux médicaments plus spécifiques et efficaces et comportant moins d’effets indésirables.
La contribution originale de Kobilka à notre compréhension des GPCR est multiple. C’est lors d’un stage postdoctoral au sein du laboratoire de Lefkowitz dans les années ‘80s que Kobilka a réussi à purifier puis cloner le récepteur beta2-adrénergique, un exploit en cette époque « prégénomique ». L’analyse de la structure du beta2-adrénergique a fourni les premiers indices de l’existence d’une famille de protéines à 7 domaines transmembranaires impliqués dans la reconnaissance et la transmission des signaux extracellulaires. En fait, à la lumière des dernières découvertes sur la transmission indépendante des protéines G, l’appellation GPCR est de plus en plus délaissée au profit de l’appellation « récepteurs à 7 domaines transmembranaires ».
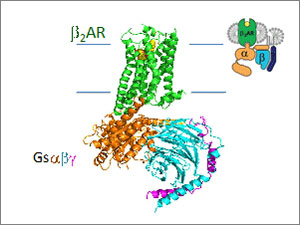 L’intérêt de Kobilka envers la structure des récepteurs à 7 domaines transmembranaires ne s’est jamais démenti. Ses efforts soutenus pour mieux caractériser la structure tridimensionnelle de ces protéines ont culminé au cours de la dernière décennie. Dans une série de publications témoignant d’une prouesse technique et d’une créativité hors du commun, Kobilka a pu révéler par cristallographie la structure tridimensionnelle du récepteur beta2-adrénergique dans son environnement membranaire, et plus récemment sous forme de complexe activé avec sa protéine G et un agoniste au site actif . En quelques années depuis, le nombre de GPCR dont la structure cristalline fine a pu être déterminée en détail est passé de 1 à 13 ! Il s’agit probablement d’une contribution clé qui a valu à Kobilka le Prix Nobel de chimie 2012, conjointement à son mentor.
L’intérêt de Kobilka envers la structure des récepteurs à 7 domaines transmembranaires ne s’est jamais démenti. Ses efforts soutenus pour mieux caractériser la structure tridimensionnelle de ces protéines ont culminé au cours de la dernière décennie. Dans une série de publications témoignant d’une prouesse technique et d’une créativité hors du commun, Kobilka a pu révéler par cristallographie la structure tridimensionnelle du récepteur beta2-adrénergique dans son environnement membranaire, et plus récemment sous forme de complexe activé avec sa protéine G et un agoniste au site actif . En quelques années depuis, le nombre de GPCR dont la structure cristalline fine a pu être déterminée en détail est passé de 1 à 13 ! Il s’agit probablement d’une contribution clé qui a valu à Kobilka le Prix Nobel de chimie 2012, conjointement à son mentor.
Pour la première fois, des données structurelles solides valident l’hypothèse selon laquelle les GPCR peuvent adopter des conformations actives multiples et ainsi entrainer des effets biologiques biaisés selon les ligands.
De Black à Lefkowitz et Kobilka, en passant par de Champlain et Bouvier – ainsi que d’autres québécois formés au sein du groupe Lefkowitz, notamment Marc Caron, André De Délan, Audrey Claing, Stéphane Laporte – ces études fonctionnelles et structurales permettront le développement rationnel de meilleurs médicaments modulateurs des GPCR, maintenant rebaptisés récepteurs à 7 domaines transmembranaires.
« The Nobel Prize in Chemistry 2012 ». Nobelprize.org. 16 Jan 2013
https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2012/
de Champlain J, Farley L, Cousineau D, van Ameringen MR. Circulating catecholamine levels in human and experimental hypertension. Circ Res. 1976;38(2):109-14.
https://www.ncbi.nlm.nih.gov/pubmed/1245019
Galandrin S, Bouvier M. Distinct signaling profiles of beta1 and beta2 adrenergic receptor ligands toward adenylyl cyclase and mitogen-activated protein kinase reveals the pluridimensionality of efficacy. Mol Pharmacol. 2006;70(5):1575-84.
https://www.ncbi.nlm.nih.gov/pubmed/16901982
« Brian K. Kobilka – Nobel Lecture: The Structural Basis of G-Protein Coupled Receptor Signaling ». Nobelprize.org. 16 Jan 2013 https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2012/kobilka-lecture.html
